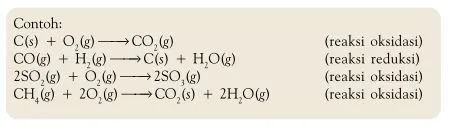Setelah mempelajari materi ini siswa diharapkan dapat menjelaskan proses pembentukan minyak bumi dan teknik pemisahan fraksi-fraksi minyak bumi serta kegunaannya.
Materi Kimia Kelas X Semester 2, Oleh Gianto, S.Pd
A. Pembentukan dan Komposisi Minyak Bumi
Istilah minyak bumi diterjemahkan dari bahasa latin (petroleum), artinya petrol (batuan) dan oleum (minyak). Nama petroleum diberikan kepada fosil hewan dan tumbuhan yang ditemukan dalam kulit bumiberupa gas alam, batubara, dan minyak bumi.
Pembentukan dan Eksplorasi
Minyak bumi terbentuk dari fosil-fosil hewan dan tumbuhan kecil yang hidup di laut dan tertimbun selama berjuta-juta tahun lampau. Ketika hewan dan tumbuhan laut mati, jasad mereka tertimbun oleh pasir dan lumpur di dasar laut. Setelah ribuan tahun tertimbun, akibat pengaruh tekanan dan suhu bumi yang tinggi, lapisan-lapisan lumpur dan pasir berubah menjadi batuan. Akibat tekanan dan panas bumi, fosil hewan dan tumbuhan yang terjebak di lapisan batuan secara perlahan berubah menjadi minyak mentah dan gas alam. Kedua bahan tersebut terperangkap di antara lapisan-lapisan batuan dan tidak dapat keluar.
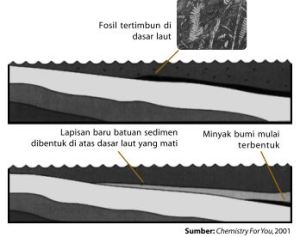 Untuk mengetahui sumber minyak bumi diperlukan pengetahuan geologi dan pengalaman. Pekerjaan ini merupakan tugas dan tanggung jawab para insinyur pertambangan dan geologi.
Untuk mengetahui sumber minyak bumi diperlukan pengetahuan geologi dan pengalaman. Pekerjaan ini merupakan tugas dan tanggung jawab para insinyur pertambangan dan geologi.
Tahap pertama eksplorasi minyak bumi adalah mencari petunjuk dipermukaan bumi seperti adanya lipatan-lipatan batuan. Lipatan-lipatan itu akibat tekanan gas dan minyak bumi yang merembes ke dalam batuan berpori sehingga minyak bumi dapat naik ke permukaan, tetapi tidak mencapai permukaan bumi karena tertahan oleh lapisann batuan lain.
Materi selengkapnya >>download
Komentar : Leave a Comment »
Kategori : Kimia SMA Kelas X
Hidrokarbon
15 04 2010
 Setelah mempelajari modul ini siswa dapat mendeskripsikan kekhasan atom karbon dalam membentuk senyawa hidrokarbon, menggolongkan senyawa hidrokarbon berdasarkan strukturnya dan hubungannya dengan sifat senyawa.
Setelah mempelajari modul ini siswa dapat mendeskripsikan kekhasan atom karbon dalam membentuk senyawa hidrokarbon, menggolongkan senyawa hidrokarbon berdasarkan strukturnya dan hubungannya dengan sifat senyawa.
Materi pelajaran KIMIA Kelas X Semester 2, Oleh Gianto,SPd
A. Karakteristik Atom Karbon
Kekhasan Atom Karbon
Atom karbon memiliki empat elektron valensi. Keempat elektron valensi tersebut dapat membentuk empat ikatan kovalen melalui penggunaan bersama pasangan elektron dengan atom-atom lain. Atom karbon dapat berikatan kovalen tunggal dengan empat atom hidrogen membentuk molekul metana (CH4).
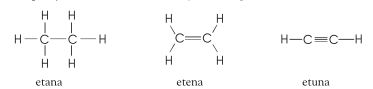
Rumus Lewisnya: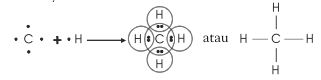 Selain dapat berikatan dengan atom-atom lain, atom karbon dapat juga berikatan kovalen dengan atom karbon lain, baik ikatan kovalen tunggal maupun rangkap dua dan tiga, seperti pada etana, etena dan etuna (lihat pelajaran Tata Nama Senyawa Organik).
Selain dapat berikatan dengan atom-atom lain, atom karbon dapat juga berikatan kovalen dengan atom karbon lain, baik ikatan kovalen tunggal maupun rangkap dua dan tiga, seperti pada etana, etena dan etuna (lihat pelajaran Tata Nama Senyawa Organik).
 Kecenderungan atom karbon dapat berikatan dengan atom karbon lain memungkinkan terbentuknya senyawa karbon dengan berbagai struktur (membentuk rantai panjang atau siklik). Hal inilah yang menjadi ciri khas atom karbon.
Kecenderungan atom karbon dapat berikatan dengan atom karbon lain memungkinkan terbentuknya senyawa karbon dengan berbagai struktur (membentuk rantai panjang atau siklik). Hal inilah yang menjadi ciri khas atom karbon.
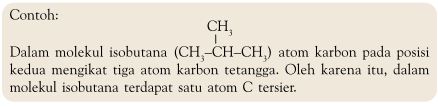
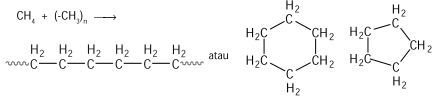 Jika satu atom hidrogen pada metana (CH4) diganti oleh gugus –CH3 maka akan terbentuk etana (CH3–CH3). Jika atom hidrogen pada etana diganti oleh gugus –CH3 maka akan terbentuk propana (CH3–CH2–CH3) dan seterusnya hingga terbentuk senyawa karbon berantai atau siklik.
Jika satu atom hidrogen pada metana (CH4) diganti oleh gugus –CH3 maka akan terbentuk etana (CH3–CH3). Jika atom hidrogen pada etana diganti oleh gugus –CH3 maka akan terbentuk propana (CH3–CH2–CH3) dan seterusnya hingga terbentuk senyawa karbon berantai atau siklik.
Atom C Primer, Sekunder, Tersier, dan Kuartener
Berdasarkan kemampuan atom karbon yang dapat berikatan dengan atom karbon lain, muncul istilah atom karbon primer, sekunder, tersier, dan kuartener. Istilah ini didasarkan pada jumlah atom karbon yang terikat pada atom karbon tertentu.
Atom karbon primer adalah atom-atom karbon yang mengikat satu atom karbon tetangga.

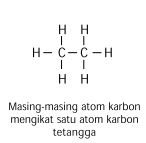 Atom karbon sekunder adalah atom-atom karbon yang mengikat dua atom karbon tetangga.
Atom karbon sekunder adalah atom-atom karbon yang mengikat dua atom karbon tetangga.
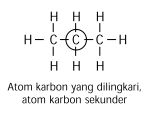 Atom karbon tersier adalah atom-atom karbon yang mengikat tiga atom karbon tetangga.
Atom karbon tersier adalah atom-atom karbon yang mengikat tiga atom karbon tetangga.
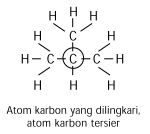 Materi selengkapnya… >> download
Materi selengkapnya… >> download
Komentar : Leave a Comment »
Kategori : Kimia SMA Kelas X
Reaksi Reduksi Oksidasi (Redoks)
14 04 2010
 Setelah mempelajari modul ini diharapkan siswa mampu menjelaskan perkembangan konsep reaksi reduksi oksidasi dan hubungannya dengan tata nama senyawa serta penerapannya.
Setelah mempelajari modul ini diharapkan siswa mampu menjelaskan perkembangan konsep reaksi reduksi oksidasi dan hubungannya dengan tata nama senyawa serta penerapannya.
Materi pelajaran KIMIA Kelas X Semester 2, Oleh Gianto,SPd
A. PENGERTIAN REDUKSI OKSIDASI
Pengikatan Oksigen :
Senyawa yang terbentuk dari hasil reaksi dengan oksigen dinamakan oksida sehingga reaksi antara oksigen dan suatu unsur dinamakan reaksi oksidasi. Karat besi adalah senyawa yang terbentuk dari hasil reaksi antara besi dan oksigen (besi oksida). Perkaratan besi merupakan salah satu contoh dari reaksi oksidasi. Persamaan reaksi pembentukan oksida besi dapat ditulis sebagai berikut.
![]()
Pada reaksi tersebut, besi mengalami oksidasi dengan cara mengikat oksigen menjadi besi oksida. Kebalikan dari reaksi oksidasi dinamakan reaksi reduksi. Pada reaksi reduksi terjadi pelepasan oksigen. Besi oksida dapat direduksi dengan cara direaksikan dengan gas hidrogen, persamaan reaksinya:
Pelepasan dan Penerimaan Elektron
Dalam konsep redoks, peristiwa pelepasan elektron dinamakan oksidasi, sedangkan peristiwa penerimaan elektron dinamakan reduksi. Reaksi redoks pada peristiwa perkaratan besi dapat dijelaskan dengan reaksi berikut:
![]() Pada reaksi tersebut, enam elektron dilepaskan oleh dua atom besi dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh karena itu, peristiwa oksidasi selalu disertai peristiwa reduksi. Pada setiap persamaan reaksi, massa dan muatan harus setara antara ruas kanan dan ruas kiri (ingat kembali penulisan persamaan reaksi). Persamaan reaksi redoks tersebut memiliki muatan dan jumlah atom yang sama antara ruas sebelah kiri dan sebelah kanan persamaan reaksi. Oksidasi besi netral melepaskan elektron yang membuatnya kehilangan muatan. Dengan menyamakan koefisiennya maka muatan pada kedua ruas persamaan reaksi menjadi sama. Penyetaraan pada reaksi reduksi oksigen juga menggunakan cara yang sama.
Pada reaksi tersebut, enam elektron dilepaskan oleh dua atom besi dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh karena itu, peristiwa oksidasi selalu disertai peristiwa reduksi. Pada setiap persamaan reaksi, massa dan muatan harus setara antara ruas kanan dan ruas kiri (ingat kembali penulisan persamaan reaksi). Persamaan reaksi redoks tersebut memiliki muatan dan jumlah atom yang sama antara ruas sebelah kiri dan sebelah kanan persamaan reaksi. Oksidasi besi netral melepaskan elektron yang membuatnya kehilangan muatan. Dengan menyamakan koefisiennya maka muatan pada kedua ruas persamaan reaksi menjadi sama. Penyetaraan pada reaksi reduksi oksigen juga menggunakan cara yang sama.
Contoh Reaksi Reduksi Oksidasi berdasarkan Transfer elektron
 Dari persamaan tersebut, dapat diketahui bahwa Mg melepaskan elektron dan Cl menerima elektron. Dengan demikian, Mg mengalami oksidasi dan Cl mengalami reduksi.
Dari persamaan tersebut, dapat diketahui bahwa Mg melepaskan elektron dan Cl menerima elektron. Dengan demikian, Mg mengalami oksidasi dan Cl mengalami reduksi.
Reduktor dan Oksidator
Dalam reaksi redoks, pereaksi yang dapat mengoksidasi pereaksi lain dinamakan zat pengoksidasi atau oksidator. Sebaliknya, zat yang dapat mereduksi zat lain dinamakan zat pereduksi atau reduktor. Pada Contoh diatas, Magnesium melepaskan elektron yang menyebabkan klorin mengalami reduksi. Dalam hal ini, magnesium disebut zat pereduksi atau reduktor. Sebaliknya, atom klorin berperan dalam mengoksidasi magnesium sehingga klorin disebut oksidator.
Contoh Reduktor dan Oksidator
Reaksi Redoks Berdasarkan Perubahan Bilangan Oksidasi
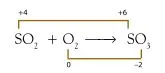
Bagaimana bilangan oksidasi dapat menjelaskan reaksi redoks? Apa Anda cukup puas dengan konsep transfer elektron? Tinjau antara reaksi SO2 dengan O2 membentuk SO3. Reaksinya dapat dituliskan sebagai berikut :
Jika dikaji berdasarkan konsep pengikatan oksigen maka reaksi tersebut adalah reaksi oksidasi. Jika dikaji berdasarkan transfer elektron maka Anda mungkin akan bingung, mengapa? Pada reaksi tersebut tidak terjadi transfer elektron, tetapi terjadi penggunaan bersama pasangan elektron membentuk ikatan kovalen. Reaksi tersebut tidak dapat dijelaskan dengan konsep transfer elektron.
Oleh karena banyak reaksi redoks yang tidak dapat dijelaskan dengan konsep pengikatan oksigen maupun transfer elektron maka para pakar kimia mengembangkan konsep alternatif, yaitu perubahan bilangan oksidasi. Menurut konsep ini, jika dalam reaksi bilangan oksidasi atom meningkat maka atom tersebut mengalami oksidasi. Sebaliknya, jika bilangan oksidasinya turun maka atom tersebut mengalami reduksi.
Untuk mengetahui suatu reaksi tergolong reaksi redoks atau bukan menurut konsep perubahan bilangan oksidasi maka perlu diketahui biloks dari setiap atom, baik dalam pereaksi maupun hasil reaksi.
Berdasarkan diagram tersebut dapat disimpulkan bahwa:
Atom S mengalami kenaikan biloks dari +4 menjadi +6, peristiwa ini disebut oksidasi; atom O mengalami penurunan biloks dari 0 menjadi –2, peristiwa ini disebut reduksi. Dengan demikian, reaksi tersebut adalah reaksi redoks.
Oleh karena molekul O2 menyebabkan molekul SO2 teroksidasi maka molekul O2 adalah oksidator. Molekul O2 sendiri mengalami reduksi akibat molekul SO2 sehingga SO2 disebut reduktor.